 歡迎來到上海韻鼎國際貿易有限公司網站!
歡迎來到上海韻鼎國際貿易有限公司網站! 歡迎來到上海韻鼎國際貿易有限公司網站!
歡迎來到上海韻鼎國際貿易有限公司網站!
1. 概述
ICH三方協調指導原則中包含了新原料和新制劑藥物的穩定性測試,其中光穩定性測試應該是強力破壞試驗的一個組成部分。該文件是總指導原則的一個補充文件,對光穩定性試驗的建議
A. 前言
新原料藥和新制劑藥物的光穩定性應當被評估和考察,以證明適當的光照不會使藥品產生不可接受的改變。正常情況下,按照總指導原則文件中批次選擇的原則,選擇一批物料,進行光穩定性測試。在某些情況下,當產品發生了改變或變化(比如,組成或者包裝)時,應該重復進行此研究。此研究是否要重復進行,取決于初期文件中所測定的光穩定性和發生改變的類型
該文件主要描述了新化合物及相關制劑藥物注冊申報時,所需要報送的光穩定性測試的試驗資料。該指南不包括給藥后的光穩定性,也不包括在總指導原則文件中沒有包含的使用。如果提供了確實可信的證據,可以選擇使用其他的方式代替
穩定性測試的系統的方法要進行的研究內容如下:
I. 原料藥光穩定性測試
II. 未進行內部包裝的藥物光穩定性測試
III. 進行了內部包裝,但是未進行外部包裝的藥物光穩定性測試
IV. 包裝已經完畢,上市藥物的光穩定性測試
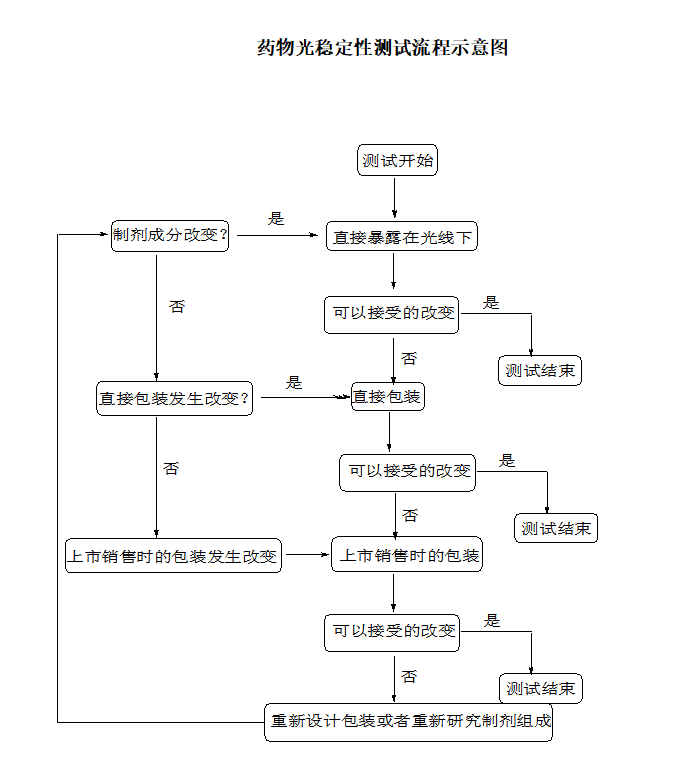
藥物測試的程度應該根據在藥物光穩定性測試的曲線示意圖中表述的,可根據到哪一步發生了可以接受的變化來決定試驗到哪一步即可停止,“可接受的變化"是指經申報者論證合理的限度內的變化。光敏性藥物和制劑是否要在標簽上標記要求,由國家地區相關管理部門來定。
B. 光源
以下描述的光源可以用于光穩定性測試。申報者應該對溫度進行適當的控制,以降低溫度對該檢測的影響或者是在相同的環境下進行暗度控制(避光對照)。對于選擇1還是2,藥劑生產者或者申報者都需要以光源的光譜分布規格為準
選擇1:采用任何輸出相似于D65/ID65 發射標淮的光源,如具有可見紫外輸出的人造日光熒光燈、 氙燈或金屬鹵化物燈。D65 是國際上認可的室外日光標準,在1993年的ISO10977中對此進行了規定,ID65是相當于室內間接日光光照的標準。光源發射光低于320nm,應當配備適當的裝置去濾除此光。
選擇2 相同的樣品可以暴露于冷白熒光燈和近紫外熒光燈。
1. 冷白熒光燈應具有與ISO10977中規定的輸出功率
2. 近紫外熒光燈可以發射的光線在320~400nm,在350~370nm有一個最大的能量發射;紫外線的重要組成部分應當是在320~360nm,和360~400nm的范圍內
C. 規程
為了進行證實試驗,樣品應該暴露在不少于1.2×106Lux·hr,近紫外能量不低于200w·hr,從而對藥物和制劑的穩定性進行直接的比較。樣品將會并排暴露于一個經過驗證的感光系統下,來保證得到了規定的光線照射,或者是在適當的時間段內,使用校正的放射計或勒克斯測量儀對條件進行了監測。如果受保護的樣品(比如,包在鋁鉑中)被用做進行暗度控制(避光對照)來評估溫度對藥物發生變化的影響,應使其與真實樣品并排放置
注解:Lux:流明,亮度單位,在英國叫做尺光度,在歐洲叫做lux,具體來說1流明相當于一只蠟燭從1米外投射在一平方米的表面上的光的數量。
1. 原料藥
對于原料藥,光穩定性測試包括兩個方面的內容:強制的降解試驗和確認性試驗,強制性降解試驗的目的是為了對光敏感性進行評估,從而建立測試的方法并且對物料的降解途徑進行評估。該檢測僅包含原料藥或者是成分較為簡單的溶液或者懸濁液,以確立驗證分析方法。在這種檢測中,樣品被放置在具有化學惰性并且透明的容器內。在這種強制性降解試驗中,根據原料藥的光敏感性和光照的強度會進行一系列的光照條件的測試。在建立和驗證方法時,如果發生了廣泛的大量的分解,就可以終止該試驗。對于光穩定性的物料,在使用了適當的光照程度后,該研究可以終止。采用的暴露水平應該得到證實,然而對于具體試驗的設計則由申請者自身的考慮。在強制性條件下我們會發現在確認性研究條件下不會形成的分解產物。該信息將會有助于對分析方法的建立和驗證。如果在實際上,在確認性試驗中,沒有降解產物形成,則不必對其再做下一步的研究為了提供處理,包裝,貼簽等必須的信息,應該進行確認性研究。
通常情況下,在研發階段,僅選擇一批原料藥,如果非常明顯的,原料藥對光穩定或者對光不穩定,應該總指導原則文件中選擇一批,來進行光穩定性的檢測。如果驗證性試驗的結果是不能確定的,則藥再對另外兩批進行測試。樣品的選擇應復核總指南文件中的描述。
A. 樣品提供
一定充分考慮到了樣品的物理性質,并且盡力保證在測試階段的物理性質,比如說采取措施:降溫或者將樣品放到密封容器內來保證物理狀態改變,比如升華,蒸發或融化。應該采取各種預防措施,以免對正在檢測中的樣品造成影響。無論與進行的試驗有無關系,都應該考慮并排除樣品和所裝容器材料之間發生的可能的反應。對于原料藥的的樣品,選擇適當數量的樣品放在適當的玻璃或者塑料盤中,如果需要的話,用一個合適的透明的蓋子蓋住。固體物料應該被均勻的撒在容器中,厚度不宜超過3毫米。液體物料應該放在化學惰性并且透明的容器內
B. 樣品分析
光照階段結束時,應該通過適當的通過驗證的分析方法對原料藥的物理性質(比如,外觀,溶液的澄清度或溶液顏色),含量和降解物等。
當使用固體物料的時候,取樣應該保證進行每一項檢測的樣品都具有一定的代表性。相似的樣品考慮,比如整個樣品的均勻性,適用于那些光照試驗后就不均勻的樣品。如果試驗中有用于暗度控制研究的樣品(可
用各種方法將樣品保護起來不受光照),則應與光照過的樣品同時測定。
C. 結果判定
強制性降解試驗應該為確認性研究的建立和驗證檢測方法提供適當的信息。這些檢測方法可以檢測到確認性研究過程中發生的光降解產物。當評估這些研究結果時,應該認識到這是強力破壞試驗的一部分,而不僅是建立一個變化的定量和定性限制。
確認性研究應該認識到生產或者藥物成分中需要的預防性措施,是否需要避光包裝。當評估確認研究結果,以判斷光照試驗產生的結果是否可以接受,很重要的一點是,必須考慮到其他正規的穩定性試驗的結果,以保證藥物在使用期間符合合理范圍。(可以參考相關的ICH穩定性和雜質指南)
2. 制劑藥物
正常情況下,制劑藥物的光穩定性研究,應該遵循如下的順序:直接將藥物暴露在光照條件下;進行了直接包裝的藥物的光照試驗,和進行了上市銷售包裝的藥物的光照試驗。檢測應該按照這樣的順序執行,直到結果證明在光照下藥物也受到了足夠的保護,即光照前后的變化在可以接受的范圍之內。此流程與順序與前文所講的藥物光穩定性測試流程示意圖時一致的。藥物應該暴露于在I.C. 章節中規定的光照條件下
正常情況下,在研發階段,選擇一批藥物進行測試,如果該制劑藥物非常明顯的具有光穩定性或者光不穩定性,應該按照總指導原則中規定的,選擇一批測試其光穩定性。如果確認性研究結果是模棱兩可的,則另外兩批的測試也是應該進行。
對于一些藥物,如果證明了光線不能穿過其直接包裝,比如鋁管或者鋁罐,正常情況下,光的穩定性測試可以僅對制劑藥物開展。
應當做一些檢測,來證明,比如注射液,皮膚用軟膏等在使用時的光穩定性。這種檢測的程度取決于使用的方式,由申報者自行決定。
采用的分析程序應當進行適當的驗證。
A. 樣品的提交
一定要認真考慮并且盡力保證受試樣品的物理性質,比如可以采取降溫、或者將樣品放置于密封容器內,來保證樣品物理狀態的變化(升華,蒸發或者溶解)。所采取的預防性措施應該可以保證對測試中的樣品接收到的光照的影響降到了最小。不管是否會對正在進行的檢測造成影響,樣品和容器材料或者對樣品的整體保護之間有可能發生的反應應該被考慮到。
在可行的條件下,當對未進行任何包裝的制劑藥物的樣品進行檢測時,其內容與檢測條件應當與相應的原料藥類似。樣品放置的位置應該提供最大的光照面積。比如,片劑,膠囊等應該單層放置。
如果直接的光線照射不可行(比如產品會氧化),則需要將樣品放在一個適當保護的惰性透明的容器內,比如石英容器。如果需要對進行了直接包裝或者上市銷售包裝的制劑藥物進行檢測的話,測試樣品應當水平地或者橫面對光,這樣可以提供統一強度的光照。當進行大容量包裝的藥物檢測時,檢測條件應該進行適當的改動,比如分裝。
B. 樣品的分析
在光照測試結束后,應該對樣品進行檢測,以發現在物理性質方面任何的改變,(比如外觀,溶液的清晰度和顏色,固體制劑類的藥物,比如膠囊等的溶解度或者崩解度),含量和降解產物等。該檢測方法應該是來源于光化學降解過程,并經過了驗證。
當樣品為粉末狀時,應該保證取樣在每個單獨檢測時樣品均一,而且由代表性。對于固體口服藥劑產品,應該對適當數量的樣品進行檢測,比如20個片劑或者20個膠囊。對光照后可能不均一的樣品(如霜劑、軟膏、混懸劑)
也同樣應考慮其采樣的代表性問題,如對整個樣品進行均勻化或溶解增溶。受試樣品應該與受保護、進行了暗度控制的樣品同時進行檢測。
C. 結果判定
應該根據光照試驗中的變化程度,進行特定的包裝或者標簽來將光照暴露降低。在對光穩定性研究結果進行評估來決定是否光照引起的變化是可以接受的時,也必須同時考慮其他穩定性研究的結果以保證在貨架壽命產品會一直在規定的規格范圍之內。